近日,3200威尼斯vip生命科学学院生物化学团队朱希课题组在Sensors and Actuators: B-Chemical(传感器和执行器 B-化学)发表题为“A highly sensitive aptamer–antibody birecognized ECL sensing platform based on the cascaded reaction between CeO2@mrGO and Co-SAC@NC for E. coli O157:H7 in untreated milk”(基于CeO2@mrGO和Co-SAC@NC级联反应的高灵敏度适配体-抗体双识别ECL传感平台用于检测未经处理的牛奶中的大肠杆菌O157:H7)的研究论文,为食品中致病菌E. coli O157:H7的检测提供了一种更加快速灵敏的新方法。

食源性疾病和食物中毒事件常由致病菌引起,对公众健康构成严重威胁。其中,大肠杆菌O157:H7 (E.coli O157:H7)是一种极具危害性的食源性病原菌。这种细菌的致病能力极强,仅需50-100个菌体(相当于普通致病菌千分之一的剂量)就能引发感染。它能产生类志贺毒素、质粒O157等多种致病物质,感染者可能出现从毫无症状到溶血性尿毒综合征等致命并发症的临床表现,是需要特别警惕的食源性致病菌。传统检测手段(如细菌培养、聚合酶链式反应PCR、酶联免疫吸附测定ELISA)不仅操作复杂耗时,还严重依赖专业设备,难以满足食品安全快检、环境实时监测、临床急诊检验等场景的迫切需求。该研究开发了一种创新性的致病菌检测技术,可直接检测复杂样本中的E.coli O157:H7,无需细菌增殖培养和昂贵设备,为食源性致病菌检测提供了高效解决方案。
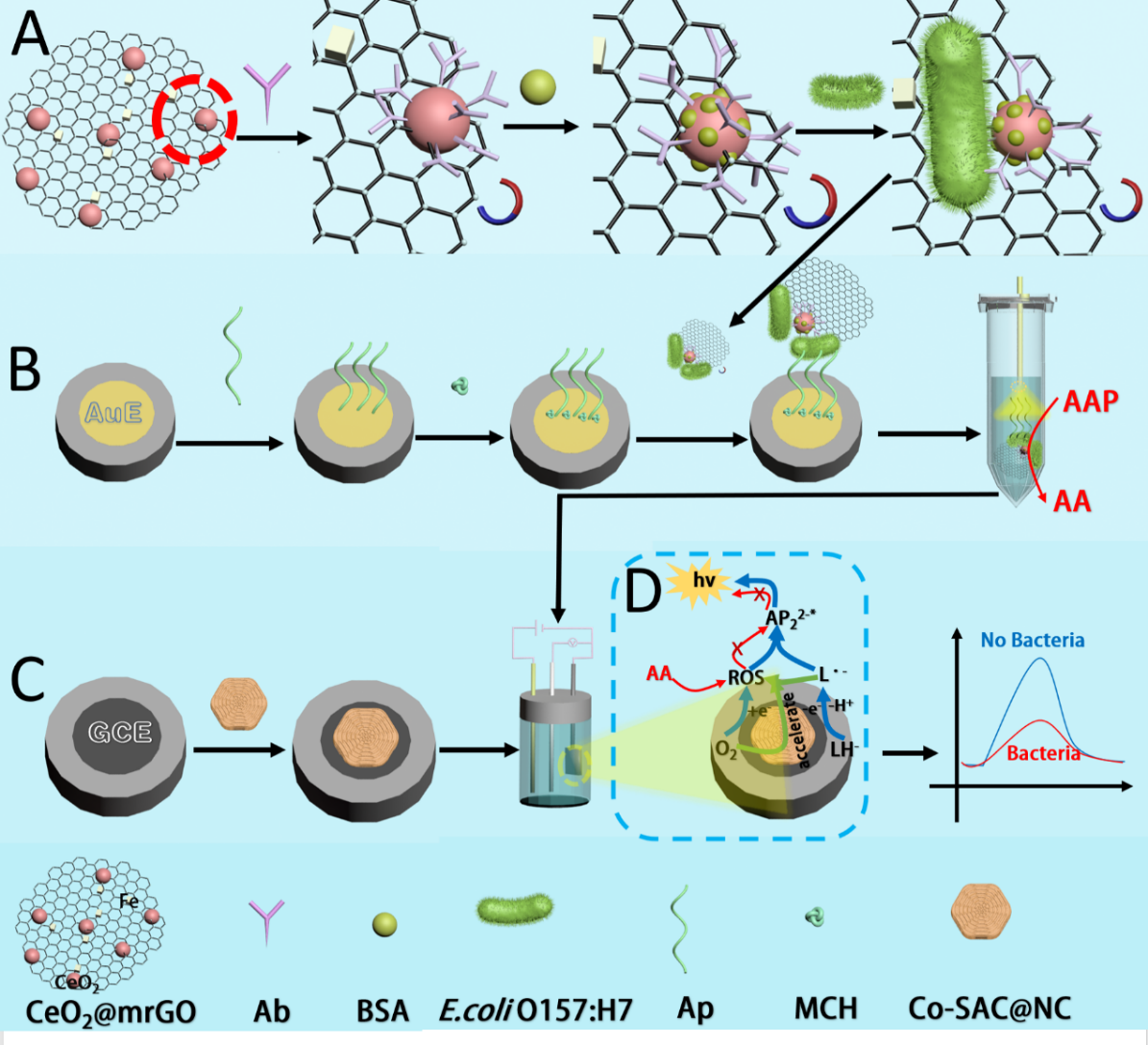
图1. 基于级联反应的适配体-抗体双识别E.coli O157:H7 ECL传感器原理
首先,制备出具有仿生催化能力的钴单原子催化剂(Co-SAC@NC),它能像天然氧化酶一样激活氧气产生活性氧。将Co-SAC@NC作为共反应促进剂,可催化O2生成活性氧,有效提高了鲁米诺-O2体系的ECL信号强度。接着,通过铁掺杂技术制备铈基纳米酶CeO2@mrGO,不仅具备磁分离功能,还展现出卓越的磷酸酶样活性。利用上述两种纳米酶的级联反应,构建了一种高敏检测E.coli O157:H7的ECL生物传感器。其检测原理如下:CeO2@mrGO共价键标记上抗体(Ab),并通过抗体捕获E.coli O157:H7,利用适配体(Ap)和抗体对E.coli O157:H7的双识别作用,在电极表面上(CeO2@mrGO-Ab/E.coli O157:H7)上形成三明治结构(CeO2@mrGO-Ab/E.coli O157:H7/Ap-AuE)。CeO2@mrGO能够将AAP转化为AA,借助AA对ROS的消耗作用,从而抑制鲁米诺-O2体系的ECL信号。该ECL传感器对E.coli O157:H7的线性响应范围为17~1.7×105 CFU/mL,检测限为2.78 CFU/mL,能够实现对E.coli O157:H7污染牛奶样本的直接检测,结果与国家标准方法相符合,为现场快速检测提供了可靠方案。
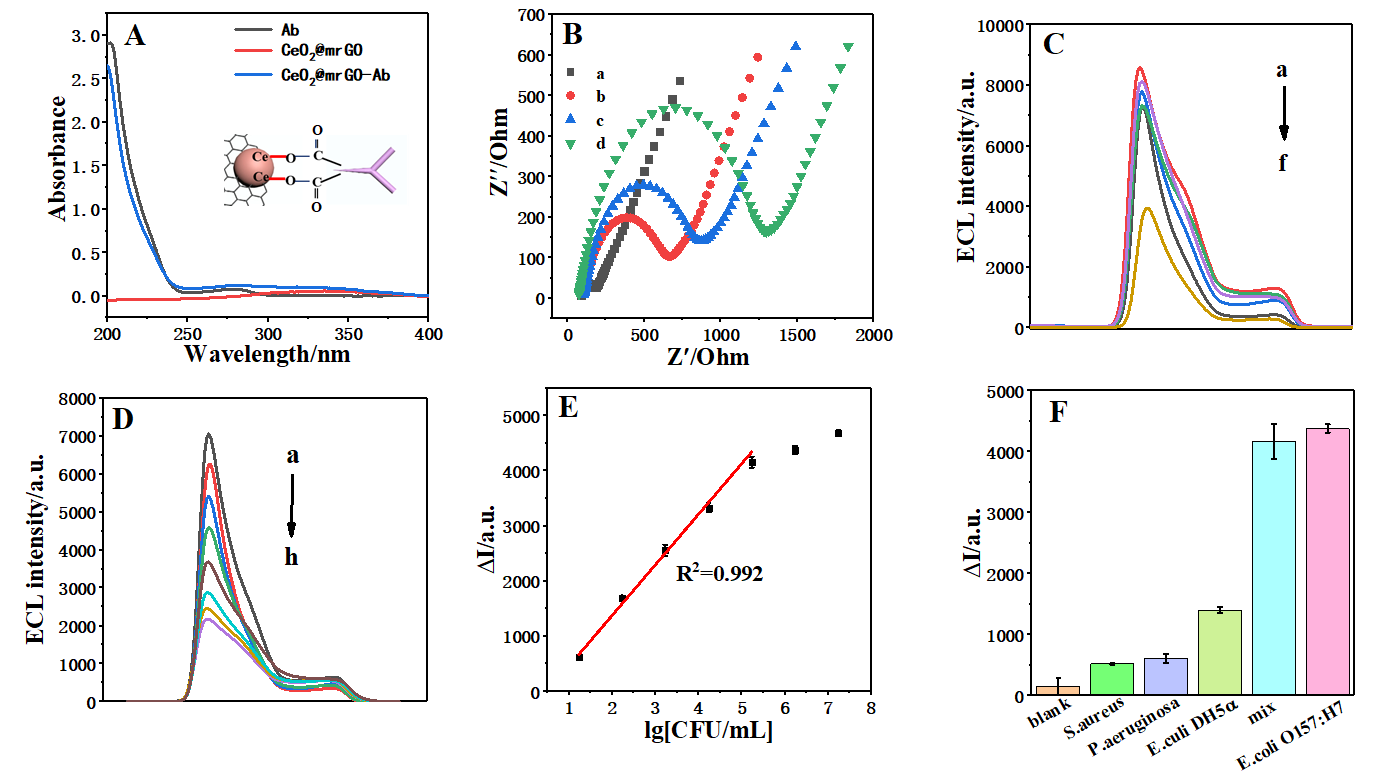
图2传感器可行性分析、ECL强度与大肠杆菌O157:H7浓度对数之间的线性关系及特异性分析
生命科学学院朱希副教授为论文第一通讯作者,在读生命科学学院硕士研究生胡震林为该论文的第一作者,在读硕士研究生程敏和郑艺靖为该论文共同作者,学院林丽萍副教授,福建中医药大学中西医结合学院许惠凤副研究员及福建医科大学药学院唐淑蓉副教授参与了研究工作。该项目研发得到国家自然科学基金资助项目、福建省自然科学基金和福建中医药大学研究基金的联合资助。
原文链接:
https://doi.org/10.1016/j.snb.2024.136756
